![]() 原因
原因
第16回全国原発性肝癌追跡調査報告では肝細胞癌の原因として71.8%がC型肝炎ウイルス,15.5%がB型肝炎ウイルスによるとされ (肝臓 46:234,2005:),肝細胞癌のほとんどが肝炎ウイルスが原因と考えられていました.また,剖検例中84%に肝硬変の合併が認められています.肝細胞癌の年間発生率は線維化の進行につれて0.5%から7.9%まで増大する (Ann Intern Med 131:174,1999)こと,日本におけるC型慢性肝炎の長期観察では5年間に9%,10年間に23%,15年間に42%の肝細胞癌の発生が報告されている(Cancer 89:539,2000)ことより,ウイルス性慢性肝障害が前癌状態と考えることができます. 近年では,ウイルス性が減少し,非アルコール性脂肪性肝障害など,非ウイルス性肝疾患を基盤とする肝細胞癌の割合が約30%と増加していることが特徴です(J Gastroenterol 45:86,2010).
![]() 対策
対策
C型慢性肝炎ではALTを低値に抑えることにより肝細胞癌の発生が低下する(5年後の肝細胞癌発生率;7.1% (ALT<80) vs 53.6% (ALT≧80),P < 0.001)と報告されています(Cancer 86:589,1999).また,インターフェロン治療により,HCV が排除できない場合でも肝発癌は抑制され(Ann Intern Med 131:174,1999 ),DAA 治療群でもインターフェロン治療群と比較して,新規の肝発癌率および肝癌治療歴のある症例での肝癌再発率のいずれも差はないと報告されています(J Hepatol 67:933,2017).
2009年には肝炎対策基本法が公布されたことを受け,各都道府県に肝炎診療協議会が設置され,各地の現状に合わせた肝炎診療ネットワークの構築が進められています.
![]() 診断
診断
2021年に日本肝臓学会より肝癌診療ガイドラインが発行されました.
図 肝細胞癌サーベイランス・診断アルゴリズム (日本肝臓学会編 肝癌診療ガイドライン2021年版)
腫瘍マーカー
AFP(α-フェトプロテイン)
胎児の血清中に検出される特殊な蛋白ですが,肝細胞癌で上昇することが知られています.肝細胞癌で産生されるAFPはレクチンという蛋白と特異的に反応する性質を用いて,レクチン結合性分画(AFP-L3)が肝細胞癌の診断に用いられています.
肝硬変で半年または1年おきに超音波検査とAFPを検査した場合,生存率の改善が報告されています(Am J Gastroenterol 97:734,2002).
PIVKAⅡ
PIVKAⅡは肝でのプロトロンビン合成の際にビタミンK欠乏により生じる蛋白質で,肝細胞癌に特異的に出現します.感度が低い点が問題でしたが,高感度PIVKA-2キットが開発され,より高い感度を示すようになりました .
肝細胞癌の診断における感度はそれぞれ,AFPが14%,AFP-L3が33%,PIVKAⅡが14%,高感度PIVKA-2が43%ですが,AFP-L3と高感度PIVKAⅡの併用で67%まで上昇すると報告されています(Int J Oncol 7:249,2000).ワーファリン内服中,閉塞性黄疸,セフェム系抗生物質使用時,アルコール性肝障害でもPIVKAⅡは上昇するので,注意が必要です.
腹部超音波検査
Bモード
通常の2次元の断層イメージです.近年性能が飛躍的に向上していますがその診断能力(感度)は70-80%と報告されています(Clin Liver Dis 5:479,2001).
カラードプラー法
探触子に向かう血流を赤,遠ざかる血流を青として,血流速度を色の濃淡で表示します.
パワードプラー法
ドプラー信号の強度をカラー化したもので,血流の方向の情報はありませんが,細い血管の描出にも優れます.造影剤との併用により高い確率で肝細胞癌と良性疾患の鑑別が可能とされています(Hepatology 24:1109,2001).
ハーモニックエコー
超音波の伝播に伴って生じるエコー信号の高周波成分を受信し映像化する方法です.高周波成分を利用することにより,方位分解能,コントラスト分解能に優れます.
造影エコー
2007年1月10日認可された超音波造影剤ソナゾイドにより診断能力の向上が期待されます.
腹部CT検査
ヘリカル CT
動脈相,門脈相,平衡相の三相の撮影が可能です.
動注CT
CTA:カテーテルを肝動脈に挿入して造影剤を注入しながらCTを撮影します.この方法により動脈血流量の状態を調べることができます.
CTAP:カテーテルを上腸間膜動脈に挿入してここから造影剤を注入し,その造影剤が門脈に帰ってきたタイミングを計ってCTを撮影します.この方法により門脈血流量の状態を調べることができます.
腹部MRI検査
単純MRI
断層面が選択できるため,3次元的な位置関係の把握に有用です.
Dynamic MRI
血行動態の評価が可能です.
造影MRI
造影剤としてmeglumine gadopentetate(マグネビスト),ferumoxides(フェリデックス)があります.meglumine gadopentetateの診断に対する感度は81%,特異性は94%と報告されています(Hepatology 34:1109,2001).
血管造影
主として治療目的で施行されますが,血管造影下CT検査は最も感度の良い検査方法と考えられています.
肝生検
最も確実な診断法ですが皮下(皮膚臨床 38:998,1996),胸壁(日消誌 87:1253,1990),腹壁(日赤医学 46:236,1994)への転移が報告されているので慎重な適応の決定が必要と思われます.
病期分類
表 病期分類(日本肝癌研究会)
|
病期 |
I |
Ⅱ |
Ⅲ |
Ⅳ |
||
| A | B | |||||
| T | T1 | T2 | T3 | T4 | any T | any T |
| N | N0 | N0 | N0 | N0 | N1 | any N |
| M | M0 | M0 | M0 | M0 | M0 | M1 |
原発腫瘍 T1 単発,≦2cm,脈管浸潤なしの3項目合致 T2 単発,≦2cm,脈管浸潤なしの2項目合致 T3 単発,≦2cm,脈管浸潤なしの1項目合致 T4 単発,≦2cm,脈管浸潤なしのすべて合致せず 所属リンパ節 N0 所属リンパ節転移なし N1 所属リンパ節転移あり 遠隔転移 M0 遠隔転移なし M1 遠隔転移あり
![]() 治療
治療

*1:肝切除の場合は肝障害度による評価を推奨
*2:Child-Pugh分類Aのみ
*3:患者年齢は65歳以下
*4:遠隔転移や脈管侵襲なし,腫瘍径5cm以内かつ腫瘍数5個以内かつAFP 500ng/mL以下
図 肝細胞癌治療アルゴリズム (日本肝臓学会編 肝癌診療ガイドライン2021年版)
手術
根治手術が可能であった症例でも5年以内に70%以上の再発をみる点(Cancer 71:19,1993)が問題です.5年生存率は37%,5年後の肝細胞癌無再発率は20%と報告されています(Ann Surg 234:63,2001).C型肝炎による肝細胞癌の手術後にインターフェロンを投与することにより再発率の低下が報告されています(投与群 vs 非投与群;33% vs 80%)(Ann Int Med 134:963,2001).
PEIT (percutaneous ethanol injection therapy)
超音波で確認した肝細胞癌に細い針を挿入し,アルコールを注入することにより肝細胞癌を死滅させる治療法です.効果が皮膜により制限される点が短所です.3年後の生存率は84%ですが,再発も81%と効率である点が問題です(Cancer 86:1682,1999).PEIT後の予後にAFP,トランスアミナーゼの上昇と血小板の減少が関係すると報告されています(Cancer 92:126,2001).また,TAEとの併用が効果的とされています(Radiology 197:812,1995).必要なアルコール量は4/3×π×(半径+0.5cm)が目安となります.
TAE(transcatheter arterial embolization)
肝細胞は肝動脈と門脈の二重の血流を受けていますが肝細胞癌は肝動脈からのみ血流を受けています.このため,肝動脈を詰めることにより肝細胞癌のみ死滅させる治療法です.腫瘍容積が200ml以下,肝全体に対する容積が5%以下,75%以上にリピオドールの停滞が認められた場合に予後が良いとされています(Radiology 214:349,2000).問題点は側副血行路の出現とTAE後の肝機能の悪化です.切除不能な肝細胞癌症例に対するTAEの効果は3年生存率が19%であり,AFP>400U/l,腫瘍サイズ>50%,ChildCの症例ではTAEの効果は期待できないと報告されています(Cancer 88:50,2000).また,同様に切除不能な肝細胞癌症例に対するTAEの効果は対症療法と比較して延命に寄与していない(J Hepatol 29:129,1998)との報告もあります.TACE(transcatheter arterial chemolipiodolization)は油性造影剤のリピオドールと制癌剤で乳濁液を作成し動脈投与する方法です(Eur J Cancer Clin Oncol 19:1053,1983).動脈塞栓術と併用されることが多い治療法です.2014年よりマイクロスフィアが承認され,より末梢肝動脈での閉塞,抗癌剤徐放効果が可能となりました.
凝固法
PMCT (percutaneous microwave coagulation therapy)
1996年4月より保険適応が認められ普及しつつある治療法で,電子レンジと同じ原理のマイクロ波により癌細胞を熱で凝固する治療法です.腫瘍径20mm未満が良い適応と報告されています(肝臓 25:262,2000).合併症として治療中の出血により腹腔内に転移を認めた報告があります(肝臓 41:496,2000).
RFA (radiofrequency ablation)
電極に高周波電流を流しコンピューターで温度調節をし,熱で癌細胞を凝固する方法です.先端の形状によりcool-tip型とexpandable型があり,expandable型は広い範囲(腫瘍径40mm)が凝固できる点が特徴です.ラジオ波による治療後12カ月の局所再発率は3.6%と報告されています(Ann Surg 232:381,2000).一方,穿刺経路の癌の播種が12.5%にみられた(Hepatology33:1124,2001)との報告があり,施行時には注意が必要です.長期予後に関しては径35mm以下の症例では1年生存率が89%,5年生存率が33%と報告されています(Eur Radiol 11:914,2001).2004年4月より保険適応となりました.PEITとの比較では局所再発率,予後のいずれも勝っていることより(Radiology 228::235,2003),肝細胞癌の局所療法の中心と考えられます. 大型肝細胞癌に対してもTAEとの併用により,RFAまたはTAE単独療法に比べて生存率の向上が認められています(JAMA 299:1669,2008).2012年よりバイポーラ電極が保険適応となり,熱傷および出血・播種のリスクが軽減されています.
穿刺針
RITA RTC Cool-tip CelonPOWER RITA Medical System Boston Scientific Century Medical Olympus
放射線療法
有害事象が少なく,痛みを伴わず,治療中の良好な全身状態を保てる点が長所です.
陽子線治療(J Clin Oncol 23:1839,2005)
重粒子線治療
インターフェロン
C型肝硬変症例にインターフェロンを投与することにより肝細胞癌の発生が37%低下したとの報告もあります ( Lancet 346:1051,1995 )が,肝細胞癌の発生率の低下が認められるのは下の図に示すようにインターフェロンの効果によりウイルスが消失した症例( SVR群:sustained responce responders )( Ann Int Med 142:105,2005 )や,肝の組織像が軽度の症例のみ(J Hepatol 30:653,1999)との報告もみられます.長期の観察では10年間の累積発癌率が対照群では70%であったのに対してインターフェロン投与群では30%と明らかな差が報告されています(Lancet 357:196,2001).インターフェロンの再投与により肝細胞癌発症の低下(再投与群vs非再投与群;1.59%vs4.81%)が報告されていますが,肝炎の鎮静化が関与している可能性も否定できません(GPT<100:再投与群 vs 非再投与群;82.4%vs60.6%)(Cancer88:58,2000). また,肝細胞癌術後の再発率がインターフェロン投与により抑制されたと報告されています(Hepatology 32:228,2000).

図 肝細胞癌発生率
化学療法
インターフェロンとの併用で抗腫瘍作用が増強すると考えられています.5-FU,Cisplatin,Methotrexateとの併用で46.7%の有効率が(Oncology 55:39,1998),Cisplatin,Doxorubicinとの併用により手術不能であった36例中9例が手術可能となった(Clin Cancer Res 5:1676,1999)と報告されています.経口投与としてUFT-E(J Gastroenterol Hepatol 16:452,2001)などが使用されています.
動注化学療法
日本で開発された治療法で,肝動脈内投与として5-FU,Cisplatin が使用されていますが,未だ国際的には評価されていません.進行した肝細胞癌で抗癌剤(Cisplatin)の肝動脈内投与とインターフェロンの皮下注射により生存期間の延長が報告されています(Cancer 88:9,2000).Sorafenib投与症例に対する肝動注化学療法の上乗せ効果が報告されています(Ann Oncol 27:2090,2016).
分子標的薬
ソラフェニブ (ネクサバール®):一次治療薬
肝細胞癌で初めて有効性が示された経口分子標的薬で,血管内皮細胞や周皮細胞の増殖抑制と血管新生阻害作用を有する,マルチキナーゼ阻害薬です(Cancer Res 64:7099,2004).SHARP試験で生存期間中央値と1年生存率がプラセボに比して有意に延長したと報告されています(10.7カ月 vs 7.9カ月,44%vs 33%;p<0.001)(N Engl J Med 359:378,2008).適応は,Child-Pugh A で遠隔転移を有する場合,高度脈管浸潤を有する場合,塞栓療法ができない場合などです.
レゴラフェニブ (スチバーガ®):二次治療薬
RESORCE試験で,ソラフェニブ治療中に増悪した肝細胞癌患者における全生存期間の延長が認められ(Lancet 389:56,2017),2017年5月に二次治療薬として肝細胞癌に対する適応拡大が承認されました が,ソラフェニブと分子構造がほぼ同じマルチキナーゼ阻害薬であるため,ソラフェニブ不耐である場合は使用が困難です.切除不能な肝細胞癌のうち,がん化学療法後に増悪した場合に限り使用可能です.
レンバチニブ (レンビマ®):一次治療薬
REFLECT試験で,ソラフェニブに比較し,全生存期間における非劣性が証明され(Lancet 391:1163,2018),2018年3月23日に肝細胞癌に対する適応拡大が承認されたマルチキナーゼ阻害薬です.低分化型・非単純結節型の肝細胞癌に対しても予後延長効果が認められています.
ラムシルマブ (サイラムザ®):二次治療薬
血管内皮増殖因子受容体(VEGFR-2)に特異的に結合する血管新生阻害剤であり,REACH-2試験でAFP値400ng/ml以上のソラフェニブ治療歴のある肝細胞癌患者における全生存期間の延長が認められ(Lancet Oncol 20:282,2019),2019年6月にがん化学療法後に増悪した血清AFP値が400ng/mL以上の切除不能な肝細胞癌に対する適応が追加されました.
カボザンチニブ (カボメティクス®):二次治療薬
マルチキナーゼ阻害薬であり,CELESTIAL試験でソラフェニブ治療歴のある進行肝細胞癌患者における全生存期間の延長が認められ(N Engl J Med 379:54,2018),2019年6月にがん化学療法後に増悪した切除不能な肝細胞癌に対し承認されました.
ベバシズマブ (アバスチン®):一次治療薬
抗血管内皮細胞増殖因子(VEGF:vascular endothelial growth factor )ヒト化モノクローナル抗体である,ベバシズマブが,アテゾリズマブとの併用で肝細胞癌に対して適応拡大となりました.
免疫チェックポイント阻害剤
アテゾリズマブ (テセントリク®):一次治療薬
抗PD-L1抗体であり,IMbrave150試験でソラフェニブと比較し全生存期間の延長が認められ(N Engl J Med 382:1894,2020),2020年9月にベバシズマブとの併用で全ての切除不能な肝細胞癌に対して適応拡大となりました.
トレメリムマブ(イジュド®):一次治療薬
CTLA-4とCD80/CD86の結合を阻害することにより,T細胞の活性化を維持させることで抗腫瘍効果を発揮します.デュルバルマブとの併用により,ソラフェニブと比較し,全生存期間を延長したと報告されています(Future Oncol 18:3769,2022).
デュルバルマブ(イミフィンジ®):一次治療薬
抗PD-L1抗体であり,切除不能な肝細胞癌の一次治療として,2022年12月28日に単独およびトレメリムマブとの併用で承認されました.
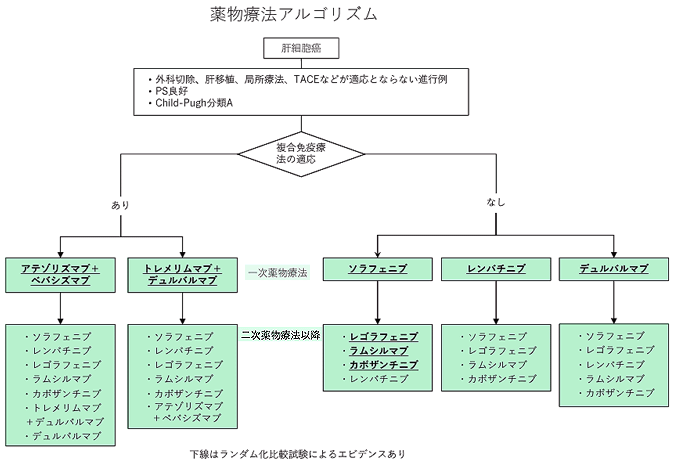
図 肝細胞癌薬物療法アルゴリズム(日本肝臓学会編「肝癌診療ガイドライン2021年版」)
増殖シグナル伝達阻害薬
mTOR(mammalian target of rapamycin )阻害薬,IGF-1R(insulin-like growth factor 1 receptor)阻害薬,TGF-βR(transforming growth factor beta receptor)阻害薬,c-Met 阻害薬などが開発されています.
肝移植
Milan criteria と呼ばれる腫瘍径30mm以下で腫瘍数が3個以内または腫瘍径50mm以下で腫瘍数が1個の状態で移植した場合は4年生存率は75%,無再発率は85%と報告されています (New Engl J Med 334:693,1996).2020年には,腫瘍径50mm以内かつ腫瘍数5個以内かつAFP 500ng/ml 以内の5-5-500基準を満たす症例にも保険適応となりました(Transpl Int 32:356,2019).B型肝炎ウイルスの場合は移植前にラミブシンを,移植後にラミブジンと抗HBs人免疫グロブリンを併用することにより再感染率の低下が報告されています(Hepatology 28:585,1998).C型肝炎ウイルスの場合は無治療の場合5年間に60-80%が慢性肝炎に,10-30%が肝硬変に移行するといわれ,移植後にインターフェロンとリバビリンの併用療法が施行されています.なお,2004年1月よりMilan criteria を満たす肝細胞癌合併非代償性肝硬変症例には生体肝移植が保険適応になり,今後症例が増加するものと考えられます.
放射線療法
3次元原体照射
肝動脈化学塞栓療法に併用された場合,奏効率および生存率が向上することが報告されています(Radiother Oncol 92:184,2009).
体幹部定位放射線治療
3次元的に線量を集中させ,治療ビームを病変に正確に照射する方法です(J Clin Oncol 26:657,2008).
粒子線治療
シンクロトロン加速器またはサイクロトロン加速器を用いて,高エネルギーの陽子あるいは炭素の原子核を照射する方法で,局所制御率が80%以上と報告されています(Cancer 117:3053,2011).
その他
アガリスク
学名をアガリスク・ブラゼイ・ムリル,和名をカワリハラタケという担子菌類で,ブラジルのサンパウロ郊外のエピダーテという山中でのみ自生するキノコです.アメリカのレーガン大統領が使用していたことで有名ですが,β-D-グルカンをはじめとした多糖類が抗腫瘍作用を有すと考えられています.
![]() 予後
予後
第16回全国原発性肝癌追跡調査報告(肝臓 46:234,2005:)では,5年生存率は手術例で54.6%,局所療法で43.4%,肝動脈塞栓療法で23.5%と報告されていますが,それぞれの対象症例の背景が異なるため,単純には比較できません.
( 第16回全国原発性肝癌追跡調査報告 )

図 肝細胞癌の累積生存率
![]()